Многие методы точной диагностики рыб: патологоанатомическое исследование, вирусное, микробиологическое исследование и другие основаны на вскрытии умершей рыбы, и не предполагают обследование живой рыбы. Конечно, они очень достоверно определяют причину гибели рыбы, однако самой рыбе уже не помочь! И направлены эти методы на предотвращение эпидемий, установление причин, повлекших болезнь и смерть гидробионта (гидрохимия, занесенные паразиты и другие причины).
Тем не менее, аквариумист может точно диагностировать и вылечить и живую рыбу!
Большинство болезней рыб имеют симптомы, так или иначе проявляющиеся в самочувствии и поведении рыбы, и многие паразиты сразу или со временем появляются на кожных покровах рыб: поэтому нет необходимости вскрывать рыбу, и достаточно взять у нее соскоб.
Соскоб у живой рыбы берут с поверхности пораженных кожных покровов (кроме жабр): язвы, покраснения, блестящая окраска и т.д., плавников, хвоста. Брать соскобы на исследование лучше в нескольких местах кожного покрова и плавников: пораженных и непораженных. Соскобы мертвых рыб всегда делают скальпелем, у живых рыб можно брать соскобы волосяной кисточкой, чтобы избежать травмирования, но при этом может не обеспечиться нужная глубина взятия пробы. Далее содержимое соскоба кладут на предметное стекло, добавляют 1-2 капли обычной водопроводной или кипяченой воды, размешивают препаровальными иглами до однообразной массы, накрывают стеклом сверху и изучают под микроскопом.
Однако такие соскобы выявляют ограниченное количество паразитов: многие болезни таким способом диагностировать невозможно, не исследуется жаберный аппарат, и можно нанести рыбе травму на коже и чешуе, что способствует проникновению в ее организм новых болезнетворных организмов.
Но есть и другой, более точный метод прижизненной диагностики рыб: изучение поверхности тела и плавников живой рыбы под стереоскопическим микроскопом типа МБС.
Метод позволяет достаточно точно и оперативно диагностировать ихтиофтириоз, хилодонеллез, триходиноз, оодиниумоз, криптобиоз, аргулез, лернеоз, писциколез.
Алгоритм действий при прижизненной диагностике болезней рыб:
Воду с рыбами аккуратно переливают в банку, при этом важно:
— не пользоваться сачком, так как сачок, особенно капроновый, удаляет часть слизи, а с ней и паразитов, с тела рыбы;
— вода должна быть аквариумной, потому что в воде с другим составом паразиты могут покинуть тело рыбы, что приведет к ошибкам в дальнейших исследованиях;
— это же относится и к температуре воды: при переливе воды, транспортировке рыбы необходимо следить за тем, чтобы температура (как впрочем, и другие параметры воды) находилась на том же уровне, что и в аквариуме.
Лучше всего достать исследуемую рыбу, просто слив воду из биотопа, и «поймав» ее банкой.
 Перед началом анализа рыбу ловят чашкой Петри: высота чашки должна соответствовать толщине тела рыбы. Чашку Петри с рыбой накрывают крышкой, лишнюю воду сливают, дно и крышку насухо вытирают фильтровальной бумагой и полотенцем.
Перед началом анализа рыбу ловят чашкой Петри: высота чашки должна соответствовать толщине тела рыбы. Чашку Петри с рыбой накрывают крышкой, лишнюю воду сливают, дно и крышку насухо вытирают фильтровальной бумагой и полотенцем.
Если тело рыбы значительно меньше высоты чашки, то необходимо накрыть рыбу внутри чашки тонким стеклом с тупыми краями, придерживая крышку чашки или стекло рукой, чтобы рыба лежала неподвижно, при этом очень важно не травмировать гидробионта!
Далее начинают исследование: чашку Петри необходимо поставить на предметный столик стереоскопического микроскопа, работающего с увеличением 16х, 32х и 56х, и осмотреть поверхность плавников кожного покрова и глаз. При микроскопии плавников используют нижнюю подсветку, а при просмотре кожного покрова и глаз рыбы — верхнюю.
Данный осмотр выявляет крупных и средних эктопаразитов рыбы: увеличения в 16х и 32х обнаруживают ихтиофтириусов, триходин, оодиниумов, а 56х — хилодонелл.
Затем исследуют слизь с кожного покрова, жабр и содержимого толстого отдела кишечника: соскобы делают предварительно увлажненными волосяными кисточками средней жесткости, а с жабр — более жесткими. Нельзя пользоваться кисточками из синтетических материалов: капрон, силон и др., потому что они травмируют рыбу.
Соскоб делается несколькими снимающими движениями кисточки с поверхности кожи, плавников и жаберных дуг. Затем слизь тупым концом скальпеля или шпателем сдавливают с кисточки на предметное стекло, предварительно капнув туда 2-3 капли водопроводной воды.
Содержимое прямой кишки исследуют следующим образом.
Рыбу кладут в обильно смоченный водой ватный тампон брюшком вверх. Пальцем проводят от брюшка к анальному отверстию рыбы, чуть-чуть надавливая, и выталкивая, таким образом, каловые массы на предметное стекло.
Далее, если каловые массы слишком сухие, к ним можно добавить несколько капель воды, перемешать их и равномерно распределить на поверхности предметного стекла, закрыть сверху покровным или тонким предметным стеклом.
Метод прижизненной диагностики позволяет провести и микробиологическое исследование рыб!
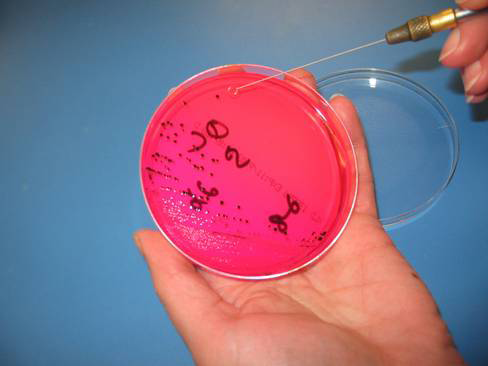
Для этого ее кладут в обильно смоченный ватный тампон, оставив открытыми наиболее пораженные участки тела и плавников и предварительно промыв их физиологическим раствором. Бактериологической петлей (петли сделаны из специальной стальной проволоки или платино — иридиевого сплава: 90/10) берут содержимое язвочек (при язвенной болезни) и пораженных участков плавников (при плавниковой гнили) и вносят его на питательные среды.
При плавниковой гнили можно и просто несколько раз приложить предметное стекло к пораженным участкам плавников рыбы.
Стоит отметить, что все же бактериологические исследования, проводимые прижизненными методами, достаточно сложны, и вносят в питательные среды много обычной микрофлоры, что серьезно усложняет рост чистой культуры патогенных бактерий, однако при необходимости сохранить рыбе жизнь, их вполне можно применять в исследованиях.
Еще одним успешным направлением в прижизненной диагностике рыб является эндоскопия, которая сегодня быстро развивается и проводится в лабораториях с помощью специализированных эндоскопов и видеосистем.

 Самое читаемое
Самое читаемое








